Sommaire
Médecine de la nature le volume 27 , des pages601–615 ( 2021 ) Citer cet article
Abstrait
Le coronavirus 2 du syndrome respiratoire aigu sévère (SRAS-CoV-2) est l’agent pathogène responsable de la pandémie de la maladie à coronavirus 2019 (COVID-19), qui a entraîné des crises sanitaires mondiales et des ressources de santé épuisées. Alors que la population de patients en convalescence du COVID-19 augmente, il est primordial d’établir une compréhension des problèmes de santé qui les entourent. Le COVID-19 est maintenant reconnu comme une maladie multi-organique avec un large spectre de manifestations. À l’instar des syndromes viraux post-aigus décrits chez les survivants d’autres épidémies virulentes de coronavirus, de plus en plus de rapports font état d’effets persistants et prolongés après le COVID-19 aigu. Les groupes de défense des patients, dont de nombreux membres s’identifient comme des transporteurs de longue durée, ont contribué à la reconnaissance du COVID-19 post-aigu, un syndrome caractérisé par des symptômes persistants et / ou des complications retardées ou à long terme au-delà de 4 semaines à compter de l’apparition des symptômes. Ici, nous fournissons une revue complète de la littérature actuelle sur le COVID-19 post-aigu, sa physiopathologie et ses séquelles spécifiques à l’organe. Enfin, nous discutons des considérations pertinentes pour les soins multidisciplinaires des survivants du COVID-19 et proposons un cadre pour l’identification des personnes à haut risque de COVID-19 post-aigu et leur prise en charge coordonnée par le biais de cliniques COVID-19 dédiées.
Principale
Le coronavirus 2 du syndrome respiratoire aigu sévère (SRAS-CoV-2), l’agent pathogène responsable de la maladie à coronavirus 2019 (COVID-19), a provoqué une morbidité et une mortalité à une échelle sans précédent dans le monde 1 . Les preuves scientifiques et cliniques évoluent sur les effets subaiguës et à long terme du COVID-19, qui peut affecter plusieurs systèmes organiques 2 . Les premiers rapports suggèrent des effets résiduels de l’infection par le SRAS-CoV-2, tels que fatigue, dyspnée, douleurs thoraciques, troubles cognitifs, arthralgie et baisse de la qualité de vie 3 , 4 , 5 . Des dommages cellulaires, une réponse immunitaire innée robuste avec production de cytokines inflammatoires et un état pro-coagulant induit par une infection par le SRAS-CoV-2 peuvent contribuer à ces séquelles 6, 7 , 8 . Les survivants des infections antérieures coronavirus, y compris l’épidémie de SRAS de 2003 et le syndrome respiratoire du Moyen – Orient (de MERS) début de 2012, ont montré une constellation similaire de symptômes persistants, ce qui renforce le souci de séquelles cliniquement significative des Covid-19 (réf. 9 , 10 , 11 , 12 , 13 , 14 , 15 ).
Une étude systématique des séquelles après la guérison d’un COVID-19 aigu est nécessaire pour développer une approche d’équipe multidisciplinaire fondée sur des données probantes pour prendre en charge ces patients et pour éclairer les priorités de recherche. Une compréhension globale des besoins de soins des patients au-delà de la phase aiguë aidera au développement d’une infrastructure pour les cliniques COVID-19 qui seront équipées pour fournir des soins multi-spécialités intégrés en ambulatoire. Bien que la définition de la chronologie post-aiguë Covid-19 est en pleine évolution, il a été suggéré d’inclure la persistance des symptômes ou le développement de séquelles au – delà de 3 ou 4 semaines après l’apparition des symptômes aigus de Covid-19 (réf. 16 , 17 ) , car le SRAS-CoV-2 apte à la réplication n’a pas été isolé après 3 semaines 18. Aux fins de cette revue, nous avons défini le COVID-19 post-aigu comme des symptômes persistants et / ou des complications retardées ou à long terme de l’infection par le SRAS-CoV-2 au-delà de 4 semaines à compter de l’apparition des symptômes (Fig.1 ). Sur la base de la littérature récente, il est divisé en deux catégories: (1) COVID-19 symptomatique subaigu ou en cours, qui comprend les symptômes et les anomalies présents de 4 à 12 semaines après le COVID-19 aigu; et (2) syndrome chronique ou post-COVID-19, qui comprend les symptômes et anomalies persistants ou présents au-delà de 12 semaines après l’apparition du COVID-19 aigu et non attribuables à d’autres diagnostics 17 , 19. Ici, nous résumons l’épidémiologie et les séquelles spécifiques aux organes du COVID-19 post-aigu et abordons les considérations de gestion pour les soins interdisciplinaires complets de ces patients dans les cliniques COVID-19 (encadré 1 et figure 2 ).
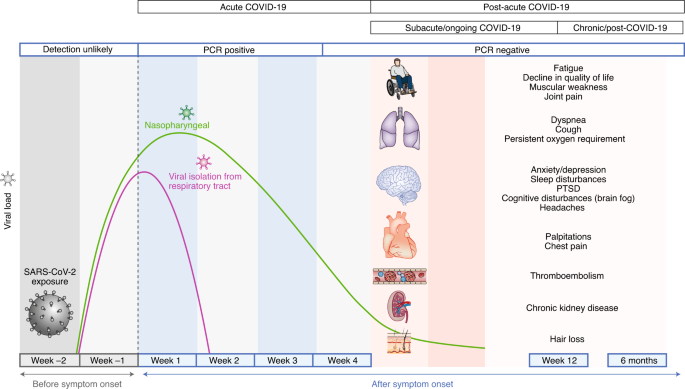 Fig.1: Chronologie du COVID-19 post-aigu.
Fig.1: Chronologie du COVID-19 post-aigu.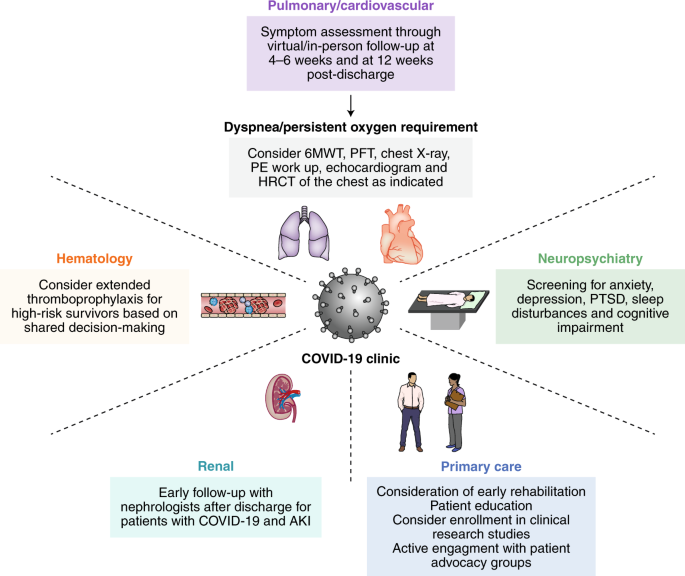 Fig. 2: Prise en charge interdisciplinaire dans les cliniques COVID-19.
Fig. 2: Prise en charge interdisciplinaire dans les cliniques COVID-19.Encadré 1 Résumé du COVID-19 post-aigu par système d’organe
Pulmonaire
- La dyspnée, la diminution de la capacité d’exercice et l’hypoxie sont des symptômes et des signes généralement persistants
- Une capacité de diffusion réduite, une physiologie pulmonaire restrictive, des opacités de verre dépoli et des changements fibreux à l’imagerie ont été notés lors du suivi des survivants du COVID-19
- L’évaluation de la progression ou de la guérison de la maladie pulmonaire et de la fonction peut inclure l’oxymétrie de pouls à domicile, les 6MWT, les PFT, la tomodensitométrie à haute résolution du thorax et l’angiographie pulmonaire par tomodensitométrie, le cas échéant.
Hématologique
- On a noté que les événements thromboemboliques étaient <5% dans le COVID-19 post-aigu dans les études rétrospectives
- La durée de l’état hyperinflammatoire induit par l’infection par le SRAS-CoV-2 est inconnue
- Direct oral anticoagulants and low-molecular-weight heparin may be considered for extended thromboprophylaxis after risk–benefit discussion in patients with predisposing risk factors for immobility, persistently elevated D-dimer levels (greater than twice the upper limit of normal) and other high-risk comorbidities such as cancer
Cardiovascular
- Persistent symptoms may include palpitations, dyspnea and chest pain
- Long-term sequelae may include increased cardiometabolic demand, myocardial fibrosis or scarring (detectable via cardiac MRI), arrhythmias, tachycardia and autonomic dysfunction
- Patients with cardiovascular complications during acute infection or those experiencing persistent cardiac symptoms may be monitored with serial clinical, echocardiogram and electrocardiogram follow-up
Neuropsychiatric
- Persistent abnormalities may include fatigue, myalgia, headache, dysautonomia and cognitive impairment (brain fog)
- Anxiety, depression, sleep disturbances and PTSD have been reported in 30–40% of COVID-19 survivors, similar to survivors of other pathogenic coronaviruses
- The pathophysiology of neuropsychiatric complications is mechanistically diverse and entails immune dysregulation, inflammation, microvascular thrombosis, iatrogenic effects of medications and psychosocial impacts of infection
Renal
- Resolution of AKI during acute COVID-19 occurs in the majority of patients; however, reduced eGFR has been reported at 6 months follow-up
- COVAN may be the predominant pattern of renal injury in individuals of African descent
- COVID-19 survivors with persistent impaired renal function may benefit from early and close follow-up in AKI survivor clinics
Endocrine
- Endocrine sequelae may include new or worsening control of existing diabetes mellitus, subacute thyroiditis and bone demineralization
- Patients with newly diagnosed diabetes in the absence of traditional risk factors for type 2 diabetes, suspected hypothalamic–pituitary–adrenal axis suppression or hyperthyroidism should undergo the appropriate laboratory testing and should be referred to endocrinology
Gastrointestinal and hepatobiliary
- Prolonged viral fecal shedding can occur in COVID-19 even after negative nasopharyngeal swab testing
- COVID-19 has the potential to alter the gut microbiome, including enrichment of opportunistic organisms and depletion of beneficial commensals
Dermatologic
- Hair loss is the predominant symptom and has been reported in approximately 20% of COVID-19 survivors
MIS-C
- Critères diagnostiques: <21 ans avec fièvre, marqueurs inflammatoires élevés, dysfonctionnement de plusieurs organes, infection actuelle ou récente par le SRAS-CoV-2 et exclusion d’autres diagnostics plausibles
- Affecte généralement les enfants de plus de 7 ans et de manière disproportionnée d’origine africaine, afro-caribéenne ou hispanique
- Des complications cardiovasculaires (anévrisme de l’artère coronaire) et neurologiques (maux de tête, encéphalopathie, accident vasculaire cérébral et convulsions) peuvent survenir
Montre plusde cette boîte
Épidémiologie
Les premiers rapports ont maintenant émergé sur les conséquences infectieuses post-aiguës du COVID-19, avec des études aux États-Unis, en Europe et en Chine rapportant les résultats pour ceux qui ont survécu à l’hospitalisation pour COVID-19 aigu. Les résultats des études rapportant les résultats du syndrome COVID-19 symptomatique subaigu / en cours et du syndrome chronique / post-COVID-19 sont résumés dans le tableau 1 .Tableau 1 Résultats des études cliniques sur la prévalence du syndrome COVID-19 post-aiguTable pleine grandeur
Une étude de cohorte observationnelle de 38 hôpitaux du Michigan, aux États-Unis, a évalué les résultats de 1250 patients sortis vivants à 60 jours en utilisant l’abstraction des dossiers médicaux et des enquêtes téléphoniques (ci-après dénommées étude américaine COVID-19 post-aiguë) 20 . Au cours de la période d’étude, 6,7% des patients sont décédés, tandis que 15,1% des patients ont dû être réadmis. Sur 488 patients qui ont répondu à l’enquête téléphonique dans cette étude, 32,6% des patients ont signalé des symptômes persistants, dont 18,9% avec des symptômes nouveaux ou aggravés. La dyspnée en montant les escaliers (22,9%) était le plus souvent signalée, tandis que les autres symptômes comprenaient la toux (15,4%) et la perte persistante du goût et / ou de l’odorat (13,1%).
Des résultats similaires ont été rapportés dans des études en Europe. Un service ambulatoire post-aigu établi en Italie (ci-après dénommé l’étude italienne post-aiguë COVID-19) 3ont rapporté la persistance des symptômes chez 87,4% des 143 patients sortis de l’hôpital qui se sont rétablis d’un COVID-19 aigu à un suivi moyen de 60 jours après l’apparition du premier symptôme. La fatigue (53,1%), la dyspnée (43,4%), les douleurs articulaires (27,3%) et les douleurs thoraciques (21,7%) étaient les symptômes les plus fréquemment rapportés, 55% des patients continuant à présenter trois symptômes ou plus. Une baisse de la qualité de vie, mesurée par l’échelle visuelle analogique EuroQol, a été notée chez 44,1% des patients de cette étude. Une étude portant sur 150 survivants de COVID-19 non critique en France a rapporté de la même manière la persistance des symptômes chez les deux tiers des personnes au suivi de 60 jours, un tiers se sentant plus mal qu’au début du COVID-19 aigu ( ref. 21). Autres études, y compris des études de suivi prospectif en personne de 110 survivants au Royaume-Uni 8 à 12 semaines après l’admission à l’hôpital 22 et 277 survivants en Espagne 10 à 14 semaines après le début de la maladie 23 , ainsi que des études d’enquête sur 100 Survivants du COVID-19 au Royaume-Uni 4 à 8 semaines après la sortie 24 , 183 personnes aux États-Unis 35 jours après la sortie 25 et 120 patients sortis de l’hôpital en France, 100 jours après l’admission 26, ont rapporté des résultats similaires. La fatigue, la dyspnée et la détresse psychologique, comme le trouble de stress post-traumatique (TSPT), l’anxiété, la dépression et la concentration et des anomalies du sommeil, ont été notées chez environ 30% ou plus des participants à l’étude au moment du suivi.
Dans une étude de cohorte prospective de Wuhan, en Chine, les conséquences à long terme du COVID-19 aigu ont été évaluées par une évaluation complète en personne de 1733 patients à 6 mois de l’apparition des symptômes (ci-après dénommée étude chinoise COVID-19 post-aiguë ) 5 . L’étude a utilisé des questionnaires d’enquête, un examen physique, des tests de marche de 6 minutes (6MWT) et des tests sanguins et, dans certains cas, des tests de la fonction pulmonaire (PFT), une tomodensitométrie à haute résolution de la poitrine et une échographie pour évaluer le COVID post-aigu. 19 fin des blessures aux organes. Une majorité de patients (76%) ont signalé au moins un symptôme. À l’instar d’autres études, la fatigue / faiblesse musculaire était le symptôme le plus fréquemment rapporté (63%), suivi des troubles du sommeil (26%) et de l’anxiété / dépression (23%).
Ces études fournissent des preuves précoces pour faciliter l’identification des personnes à haut risque de COVID-19 post-aigu. La gravité de la maladie pendant le COVID-19 aigu (mesurée, par exemple, par l’admission dans une unité de soins intensifs (USI) et / ou la nécessité d’une ventilation mécanique non invasive et / ou invasive) a été significativement associée à la présence ou à la persistance de symptômes (tels que dyspnée, fatigue / faiblesse musculaire et SSPT), réduction des scores de qualité de vie liés à la santé, anomalies de la fonction pulmonaire et anomalies radiographiques dans le cadre du COVID-19 post-aigu 5 , 22 , 24 . De plus, Halpin et al. 24ont rapporté des associations supplémentaires entre une maladie respiratoire préexistante, un indice de masse corporelle plus élevé, un âge plus avancé et des Noirs, des Asiatiques et des minorités ethniques (BAME) et la dyspnée à 4–8 semaines de suivi. L’étude chinoise sur le COVID-19 post-aigu a également suggéré des différences entre les sexes, les femmes étant plus susceptibles de ressentir de la fatigue et de l’anxiété / dépression à 6 mois de suivi 5 , comme les survivants du SRAS 15 . Alors que d’ autres comorbidités, comme le diabète, l’ obésité, des maladies chroniques cardiovasculaires ou rénales, le cancer et la transplantation d’organes, sont déterminants bien reconnus de la gravité accrue et la mortalité liées aux Covid-19 aiguë (réf. 2 , 27 ), leur association avec post les résultats aigus du COVID-19 chez ceux qui se sont rétablis restent à déterminer.
Physiopathologie
Les mécanismes physiopathologiques prédominants du COVID-19 aigu comprennent les suivants: toxicité virale directe; lésions endothéliales et lésions microvasculaires; dérégulation du système immunitaire et stimulation d’un état hyperinflammatoire; hypercoagulabilité avec thrombose et macrothrombose in situ résultantes; et une mauvaise adaptation de la voie 2 de l’enzyme de conversion de l’angiotensine 2 (ACE2) . Le chevauchement des séquelles du COVID-19 post-aigu avec celles du SRAS et du MERS peut s’expliquer par des similitudes phylogénétiques entre les coronavirus pathogènes responsables. Le chevauchement de l’identité de la séquence génomique du SARS-CoV-2 est de 79% avec le SARS-CoV-1 et de 50% avec le MERS-CoV 28 , 29. De plus, SARS-CoV-1 et SARS-CoV-2 partagent le même récepteur de cellule hôte: ACE2. Cependant, il existe des différences notables, telles que l’affinité plus élevée du SARS-CoV-2 pour ACE2 par rapport au SARS-CoV-1, ce qui est probablement dû à des différences dans le domaine de liaison au récepteur de la protéine de pointe qui médie le contact avec ACE2. Contrairement aux autres gènes structurels, le gène de pointe a divergé dans le SRAS-CoV-2, avec seulement 73% de similitude en acides aminés avec le SRAS-CoV-1 dans le domaine de liaison au récepteur de la protéine de pointe 30 . De plus, un site de clivage supplémentaire S1 – S2 dans le SARS-CoV-2 permet un clivage plus efficace par les protéases de l’hôte et facilite une liaison plus efficace 30 , 31. Ces mécanismes ont probablement contribué à une transmission plus efficace et plus répandue du SRAS-CoV-2.
Les mécanismes potentiels contribuant à la physiopathologie du COVID-19 post-aigu comprennent: (1) les changements physiopathologiques spécifiques du virus; (2) aberrations immunologiques et dommages inflammatoires en réponse à l’infection aiguë; et (3) séquelles attendues de la maladie post-critique. Alors que les deux premiers sont abordés plus en détail dans les sections spécifiques aux organes ci-dessous, le syndrome des soins post-intensifs est maintenant bien reconnu et comprend des anomalies nouvelles ou aggravées dans les domaines physique, cognitif et psychiatrique après une maladie critique 32 , 33 , 34 , 35 , 36. La physiopathologie du syndrome des soins post-intensifs est multifactorielle et a été proposée comme impliquant une ischémie et des lésions microvasculaires, une immobilité et des altérations métaboliques au cours d’une maladie grave 34 . De plus, à l’instar des études précédentes sur les survivants du SRAS, dont 25 à 30% ont souffert d’infections secondaires 37 , 38 , les survivants du COVID-19 aigu peuvent être exposés à un risque accru d’infections bactériennes, fongiques (aspergillose pulmonaire) ou d’autres agents pathogènes 39 , 40 , 41 . Cependant, ces infections secondaires n’expliquent pas les séquelles persistantes et prolongées du COVID-19 post-aigu.
Séquelles pulmonaires
Épidémiologie et manifestations cliniques
Un spectre de manifestations pulmonaires, allant de la dyspnée (avec ou sans dépendance chronique à l’oxygène) au sevrage respiratoire difficile et aux lésions pulmonaires fibreuses, a été rapporté chez les survivants du COVID-19. À l’instar des survivants du syndrome de détresse respiratoire aiguë (SDRA) d’autres étiologies, la dyspnée est le symptôme persistant le plus courant au-delà du COVID-19 aigu, avec une prévalence de 42 à 66% à 60 à 100 jours de suivi 3 , 20 , 24 , 26 . Dans l’étude chinoise sur COVID-19 post-aiguë, la distance médiane de marche de 6 minutes était inférieure aux valeurs de référence normales chez environ un quart des patients à 6 mois 5 – une prévalence similaire à celle des survivants du SRAS et du MERS 9. Le besoin d’un supplément d’oxygène en raison d’une hypoxémie persistante, ou d’une nouvelle exigence de pression positive continue des voies respiratoires ou d’une autre assistance respiratoire pendant le sommeil, a été rapporté chez 6,6 et 6,9% des patients, respectivement, à 60 jours de suivi dans le COVID post-aigu. 19 Étude américaine 20 . Parmi les 1800 patients nécessitant une trachéostomie au cours d’une COVID-19 aiguë, seuls 52% ont été sevrés avec succès de la ventilation mécanique un mois plus tard dans une étude de cohorte nationale en Espagne 42 . Une réduction de la capacité de diffusion est la déficience physiologique la plus fréquemment rapportée dans le COVID-19 post-aigu, avec une diminution significative directement liée à la gravité de la maladie aiguë 5 , 43 , 44 , 45 , 46, ce qui est conforme aux études sur les survivants du SRAS et du MERS 9 , des survivants de la grippe H1N1 légère 47 et des survivants historiques du SDRA 48 . Bien que moins fréquents, les survivants du COVID-19 hospitalisés se sont avérés avoir une physiologie pulmonaire restrictive à 3 et 6 mois 5 , 49 , ce qui a également été observé dans les populations historiques de survivants du SDRA 48 , 50 .
Environ 50% des 349 patients ayant subi une tomodensitométrie thoracique à haute résolution à 6 mois avaient au moins un schéma anormal dans l’étude chinoise sur COVID-19 post-aiguë 5 . La majorité des anomalies observées par tomodensitométrie étaient des opacités de verre dépoli. Cette étude n’a pas examiné l’embolie pulmonaire chronique car les angiographies pulmonaires par tomodensitométrie n’ont pas été obtenues. Les risques à long terme d’embolie pulmonaire chronique et d’hypertension pulmonaire qui en résulte sont inconnus à l’heure actuelle. Des changements fibrotiques sur des tomodensitométries thoraciques, consistant principalement en réticulations ou bronchectasies de traction, ont été observés 3 mois après la sortie de l’hôpital chez environ 25 et 65% des survivants dans les études de cohorte de cas légers à modérés 45et la plupart des cas graves 49 , respectivement, qui se distinguent par un besoin d’oxygène supplémentaire. Cependant, ces estimations de prévalence doivent être considérées comme préliminaires compte tenu de la taille de l’échantillon de chacune de ces cohortes. Les estimations de la prévalence des séquelles post-aiguës du COVID-19 issues de ces études suggèrent que les patients présentant une gravité plus élevée du COVID-19 aigu (en particulier ceux nécessitant une canule nasale à haut débit et une ventilation mécanique non invasive ou invasive) sont les plus à risque complications pulmonaires à long terme, y compris troubles persistants de la diffusion et anomalies pulmonaires radiographiques (telles que la fibrose pulmonaire) 5 , 22 .
Pathologie et physiopathologie
Les mécanismes viraux (y compris l’invasion des cellules épithéliales et endothéliales alvéolaires par le SRAS-CoV-2) et les mécanismes indépendants du virus (tels que les dommages immunologiques, y compris l’inflammation périvasculaire) contribuent à la rupture de la barrière endothéliale-épithéliale avec invasion des monocytes et neutrophiles et extravasation d’un exsudat riche en protéines dans l’espace alvéolaire, compatible avec d’autres formes de SDRA 51 . Toutes les phases de lésions alvéolaires diffuses ont été rapportées dans la série d’autopsies COVID-19, avec des lésions alvéolaires diffuses fibroprolifératives focales et organisées plus tard dans l’évolution de la maladie 52 , 53 , en accord avec d’autres étiologies du SDRA 54 , 55. De rares zones de prolifération de myofibroblastes, de fibrose murale et de nid d’abeilles microcystiques ont également été notées. Cet état fibrotique peut être provoqué par des cytokines telles que l’interleukine-6 (IL-6) et le facteur de croissance transformant-β, qui ont été impliqués dans le développement de la fibrose pulmonaire 6 , 56 , 57 , 58 et peuvent prédisposer à la colonisation bactérienne et subséquente infection 59 , 60 , 61. L’analyse du tissu pulmonaire de cinq cas de pneumonie grave associée au COVID-19, y compris deux échantillons d’autopsie et trois échantillons provenant de poumons explantés de receveurs d’une transplantation pulmonaire, a montré des modèles d’expression d’ARN histopathologiques et unicellulaires similaires à la fibrose pulmonaire au stade terminal sans persistance. Infection par le SRAS-CoV-2, suggérant que certaines personnes développent une fibrose pulmonaire accélérée après la résolution de l’infection active 62 .
Une microthrombose vasculaire pulmonaire et une macrothrombose ont été observées chez 20 à 30% des patients atteints de COVID-19 (réf. 63 , 64 , 65 , 66 , 67 ), ce qui est plus élevé que dans les autres populations de patients gravement malades (1 à 10%) 68 , 69 . En outre, la gravité de la lésion endothéliale et de la thrombose généralisée avec microangiopathie observée à l’autopsie pulmonaire est supérieure à celle observée dans le SDRA de la grippe 70 , 71 .
Considérations de gestion
Les soins post-hospitaliers des survivants du COVID-19 ont été reconnus comme une priorité de recherche majeure par les organisations professionnelles 72 , et les orientations pour la prise en charge de ces patients évoluent encore 19 . L’oxymétrie de pouls à domicile utilisant des dispositifs approuvés par la Food and Drug Administration a été suggérée comme un outil utile pour surveiller les patients présentant des symptômes persistants; cependant, les preuves à l’appui font actuellement défaut 73 , 74 . Certains experts ont également proposé une évaluation avec des PFT en série et des 6MWT pour les personnes souffrant de dyspnée persistante, ainsi qu’une tomodensitométrie à haute résolution du thorax à 6 et 12 mois 75 .
Dans un document d’orientation adopté par la British Thoracic Society, les algorithmes d’évaluation des survivants du COVID-19 au cours des 3 premiers mois suivant la sortie de l’hôpital sont basés sur la gravité du COVID-19 aigu et sur le fait que le patient a reçu ou non des soins de niveau USI 76. Les algorithmes pour les groupes COVID-19 sévères et légers à modérés recommandent une évaluation clinique et une radiographie pulmonaire chez tous les patients à 12 semaines, ainsi que la prise en compte des PFT, des 6MWT, des prélèvements d’expectorations et de l’échocardiogramme selon le jugement clinique. Sur la base de cette évaluation de 12 semaines, il est en outre recommandé aux patients d’être évalués avec une tomodensitométrie haute résolution du thorax, une angiographie pulmonaire par tomodensitométrie ou une échocardiographie, ou être renvoyés du suivi. En plus de cette évaluation de 12 semaines, une évaluation clinique plus précoce des séquelles respiratoires, psychiatriques et thromboemboliques, ainsi que des besoins de rééducation, est également recommandée 4 à 6 semaines après le congé pour les personnes atteintes de COVID-19 aigu sévère, définies comme avez une pneumonie sévère, a nécessité des soins en USI, êtes âgé ou présentez plusieurs comorbidités.
Le traitement par corticostéroïdes peut être bénéfique dans un sous-ensemble de patients atteints de maladie pulmonaire inflammatoire post-COVID, comme le suggère une observation préliminaire d’une amélioration symptomatique et radiologique significative dans une petite cohorte britannique de survivants du COVID-19 avec une pneumonie organisée 6 semaines après la sortie de l’hôpital. 77 . L’utilisation de stéroïdes pendant le COVID-19 aigu n’a pas été associée à une altération de la diffusion et des anomalies radiographiques à 6 mois de suivi dans l’étude chinoise COVID-19 post-aiguë 5 . La transplantation pulmonaire a déjà été réalisée pour une maladie pulmonaire fibroproliférative après SDRA 78 en raison de la grippe A (H1N1) 79 et Covid-19 (réf. 62 , 80). Des essais cliniques de thérapies antifibrotiques pour prévenir la fibrose pulmonaire après le COVID-19 sont en cours (Tableau 2 ) 81 .Tableau 2 Études de recherche actives et questions relatives au COVID-19 post-aiguTable pleine grandeur
Séquelles hématologiques
Épidémiologie et manifestations cliniques
Les données rétrospectives sur les événements thromboemboliques post-aigus, bien que limitées par la petite taille de l’échantillon, la variabilité dans la détermination des résultats et un suivi systématique inadéquat, suggèrent que le taux de thromboembolie veineuse (TEV) dans le cadre du COVID-19 post-aigu est <5% . Un rapport monocentrique de 163 patients des États-Unis sans thromboprophylaxie post-décharge a suggéré une incidence cumulée de 2,5% de thrombose 30 jours après la sortie, y compris embolie pulmonaire segmentaire, thrombus intracardiaque, fistule artério-veineuse thrombosée et accident vasculaire cérébral ischémique 82. La durée médiane de ces événements était de 23 jours après le congé. Dans cette même étude, il y avait une incidence cumulative de 3,7% d’hémorragie 30 jours après la sortie, principalement liée à des chutes mécaniques. Des taux de TEV similaires ont été rapportés dans des études rétrospectives au Royaume-Uni 83 , 84 . Une étude prospective menée en Belgique à 6 semaines de suivi après le congé a évalué les taux de D- dimère et l’échographie veineuse chez 102 patients; 8% ont reçu une thromboprophylaxie après leur congé 85. Un seul événement de TEV asymptomatique a été signalé. De même, aucune TVP n’a été observée chez 390 participants (sélectionnés à l’aide d’une procédure d’échantillonnage stratifié pour inclure ceux avec une gravité plus élevée de COVID-19 aigu) qui ont eu une échographie des membres inférieurs dans l’étude chinoise COVID-19 post-aiguë 5 . Des études en cours de plus grande envergure, telles que CORONA-VTE, CISCO-19 et CORE-19, aideront à établir des taux plus définitifs de ces complications 86 , 87 .
Pathologie et physiopathologie
Contrairement à la coagulopathie consommatrice caractéristique de la coagulation intravasculaire disséminée, la coagulopathie associée au COVID-19 est cohérente avec un état hyperinflammatoire et hypercoagulable 88 , 89 . Cela peut expliquer les taux disproportionnellement élevés (20 à 30%) de complications thrombotiques plutôt que hémorragiques dans le COVID-19 aigu (réf. 90 ). Les mécanismes de la thrombo-inflammation comprennent les lésions endothéliales 70 , 91 , 92 , 93 , l’activation du complément 94 , 95 , 96 , l’activation plaquettaire et les interactions plaquettes-leucocytes 97 , 98 , 99, pièges extracellulaires à neutrophiles 95 , 100 , 101 , libération de cytokines pro-inflammatoires 102 , perturbation des voies coagulantes normales 103 et hypoxie 104 , similaire à la physiopathologie des syndromes de microangiopathie thrombotique 105 . Le risque de complications thrombotiques dans la phase post-aiguë du COVID-19 est probablement lié à la durée et à la sévérité d’un état hyperinflammatoire, bien que la durée de sa persistance soit inconnue.
Considérations de gestion
Bien que des preuves concluantes ne soient pas encore disponibles, un congé post-hospitalier prolongé (jusqu’à 6 semaines) et une thromboprophylaxie primaire prolongée (jusqu’à 45 jours) chez les patients traités en ambulatoire peuvent avoir un rapport bénéfice / risque plus favorable dans le COVID-19 compte tenu des augmentation des complications thrombotiques pendant la phase aiguë, et il s’agit d’un domaine d’investigation active ( NCT04508439 , COVID- PREVENT ( NCT04416048 ), ACTIV4 ( NCT04498273 ) et PREVENT -HD ( NCT04508023 )) 106 , 107 . Élevé D-des taux de dimère (supérieurs à deux fois la limite supérieure de la normale), en plus des comorbidités telles que le cancer et l’immobilité, peuvent aider à stratifier le risque des patients présentant le risque le plus élevé de thrombose post-aiguë; cependant, les considérations individuelles au niveau du patient pour le risque par rapport aux avantages devraient dicter les recommandations pour le moment 86 , 108 , 109 , 110 .
Les anticoagulants oraux directs et l’héparine de bas poids moléculaire sont les agents anticoagulants préférés aux antagonistes de la vitamine K en raison du manque de nécessité de surveiller fréquemment les niveaux thérapeutiques, ainsi que du risque plus faible d’interactions médicamenteuses 108 , 109 . Une anticoagulation thérapeutique pour les personnes atteintes de TEV confirmée par imagerie est recommandée pendant ≥ 3 mois, similaire à la TEV provoquée 72 , 111 . Le rôle des agents antiplaquettaires tels que l’aspirine comme alternative (ou en association avec des agents anticoagulants) pour la thromboprophylaxie dans le COVID-19 n’a pas encore été défini et est actuellement étudié comme stratégie de thromboprophylaxie primaire prolongée chez les patients traités en ambulatoire (ACTIV4 ( NCT04498273))). L’activité physique et la marche devraient être recommandées à tous les patients, le cas échéant 102 .
Séquelles cardiovasculaires
Épidémiologie et manifestations cliniques
Des douleurs thoraciques ont été signalées chez jusqu’à ~ 20% des survivants du COVID-19 à 60 jours de suivi 3 , 21 , tandis que des palpitations et des douleurs thoraciques en cours ont été signalées chez 9 et 5%, respectivement, à 6 mois de suivi dans le post -étude chinoise COVID-19 aiguë 5 . Une incidence accrue de cardiomyopathie de stress a été notée pendant la pandémie COVID-19 par rapport aux périodes pré-pandémiques (7,8 contre 1,5 à 1,8%, respectivement), bien que les taux de mortalité et de réhospitalisation chez ces patients soient similaires 112. Les données préliminaires avec l’imagerie par résonance magnétique cardiaque (IRM) suggèrent que l’inflammation myocardique continue peut être présente à des taux aussi élevés que 60% plus de 2 mois après un diagnostic de COVID-19 dans un centre de test COVID, bien que la reproductibilité et la cohérence de ceux-ci les données ont été débattues 113 . Dans une étude menée auprès de 26 athlètes universitaires de compétition atteints d’une infection légère ou asymptomatique du SRAS-CoV-2, l’IRM cardiaque a révélé des caractéristiques diagnostiques de myocardite chez 15% des participants et des lésions myocardiques antérieures chez 30,8% des participants 114 .
Pathologie et physiopathologie
Les mécanismes perpétuant les séquelles cardiovasculaires dans le COVID-19 post-aigu comprennent l’invasion virale directe, la régulation négative de l’ECA2, l’inflammation et la réponse immunologique affectant l’intégrité structurelle du myocarde, du péricarde et du système de conduction. Des études d’autopsie dans 39 cas de COVID-19 ont détecté un virus dans le tissu cardiaque de 62,5% des patients 115 . La réponse inflammatoire ultérieure peut entraîner la mort des cardiomyocytes et le déplacement fibro-graisseux des protéines desmosomales importantes pour l’adhérence de cellule à cellule 116 , 117 .
Les patients guéris peuvent avoir une demande cardiométabolique constamment augmentée, comme cela a été observé dans l’évaluation à long terme des survivants du SRAS 118 . Cela peut être associé à une réduction de la réserve cardiaque, à l’utilisation de corticostéroïdes et à une dérégulation du système rénine-angiotensine-aldostérone (SRAA). La fibrose ou la cicatrisation myocardique et la cardiomyopathie résultant d’une infection virale peuvent entraîner des arythmies ré-entrantes 119 . Le COVID-19 peut également perpétuer les arythmies dues à un état catécholaminergique accru dû à des cytokines telles que l’IL-6, l’IL-1 et le facteur de nécrose tumorale α, qui peuvent prolonger les potentiels d’action ventriculaire en modulant l’expression des canaux ioniques des cardiomyocytes 120. Un dysfonctionnement de l’autonomie après une maladie virale, entraînant un syndrome de tachycardie orthostatique posturale et une tachycardie sinusale inappropriée, a déjà été signalé à la suite d’une modulation adrénergique 121 , 122 .
Considérations de gestion
Une évaluation clinique et d’imagerie en série avec électrocardiogramme et échocardiogramme à 4–12 semaines peut être envisagée chez les personnes présentant des complications cardiovasculaires au cours d’une infection aiguë ou des symptômes cardiaques persistants 76 , 123 . Les preuves actuelles ne soutiennent pas l’utilisation systématique de l’imagerie cardiaque avancée, et cela doit être envisagé au cas par cas. Les recommandations pour les athlètes de compétition souffrant de complications cardiovasculaires liées au COVID-19 incluent l’abstinence des sports de compétition ou de l’activité aérobie pendant 3 à 6 mois jusqu’à la résolution de l’inflammation myocardique par IRM cardiaque ou normalisation de la troponine 124 , 125 .
Malgré les préoccupations théoriques initiales concernant l’augmentation des taux d’ECA2 et le risque de COVID-19 aigu avec l’utilisation d’inhibiteurs du RAAS, ils se sont avérés sûrs et devraient être poursuivis chez les personnes atteintes d’une maladie cardiovasculaire stable 126 , 127 . Au lieu de cela, l’arrêt brutal des inhibiteurs du RAAS peut être potentiellement dangereux 128 . Chez les patients présentant un dysfonctionnement ventriculaire, un traitement médical conforme aux directives doit être instauré et optimisé en fonction de la tolérance 129 . Retrait de la thérapie médicale dirigée directive-a été associée à une mortalité plus élevée dans l’aigu par rapport à la phase post-aiguë lors d’ une étude rétrospective de 3080 patients atteints de Covid-19 (réf. 130). Les patients présentant un syndrome de tachycardie orthostatique posturale et une tachycardie sinusale inappropriée peuvent bénéficier d’un bêtabloquant à faible dose pour la gestion de la fréquence cardiaque et la réduction de l’activité adrénergique 131 . Une attention particulière est justifiée à l’utilisation de médicaments tels que les agents anti-arythmiques (par exemple, l’amiodarone) chez les patients présentant des modifications pulmonaires fibreuses après COVID-19 (réf. 132 ).
Séquelles neuropsychiatriques
Épidémiologie et manifestations cliniques
Semblable au syndrome post-SRAS chronique, les survivants du COVID-19 ont signalé un syndrome post-viral de malaise chronique, de myalgie diffuse, de symptômes dépressifs et de sommeil non réparateur 133 , 134 . D’autres manifestations post-aiguës du COVID-19 comprennent des céphalées de type migraine 135 , 136 (souvent réfractaires aux analgésiques traditionnels 137 ) et des céphalées d’apparition tardive attribuées à des niveaux élevés de cytokines. Dans une étude de suivi portant sur 100 patients, environ 38% avaient des maux de tête persistants après 6 semaines 138 . La perte de goût et d’odorat peut également persister après la résolution d’autres symptômes chez environ un dixième des patients jusqu’à 6 mois de suivi 5 , 20 , 22, 26 . Des troubles cognitifs ont été notés avec ou sans fluctuations, y compris le brouillard cérébral, qui peut se manifester par des difficultés de concentration, de mémoire, de langage réceptif et / ou de fonction exécutive 139 , 140 , 141 .
Les personnes atteintes de COVID-19 présentent une gamme de symptômes psychiatriques qui persistent ou se présentent des mois après l’infection initiale 142 . Dans une cohorte de 402 survivants du COVID-19 en Italie 1 mois après l’hospitalisation, environ 56% ont fait un dépistage positif dans au moins un des domaines évalués pour les séquelles psychiatriques (ESPT, dépression, anxiété, insomnie et symptomatologie obsessionnelle compulsive) 143 . Une dépression et une anxiété cliniquement significatives ont été signalées chez environ 30 à 40% des patients après COVID-19, comme les patients ayant déjà eu des infections sévères à coronavirus 11 , 12 , 15 , 143 , 144. L’anxiété, la dépression et les troubles du sommeil étaient présents chez environ un quart des patients à 6 mois de suivi dans l’étude chinoise post-aiguë COVID-19 5 . Notamment, des symptômes de SSPT cliniquement significatifs ont été signalés chez environ 30% des patients atteints de COVID-19 nécessitant une hospitalisation et peuvent se manifester tôt au cours d’une infection aiguë ou des mois plus tard 143 , 144 . Une analyse d’un ensemble de données à grande échelle dans le monde réel de 62354 survivants du COVID-19 de 54 établissements de santé aux États-Unis a estimé à 18,1% l’incidence de la première maladie psychiatrique récurrente entre 14 et 90 jours de diagnostic 145.. Plus important encore, il a rapporté que la probabilité globale estimée de diagnostic d’une nouvelle maladie psychiatrique dans les 90 jours suivant le diagnostic du COVID-19 était de 5,8% (trouble anxieux = 4,7%; trouble de l’humeur = 2%; insomnie = 1,9%; démence (parmi ceux-ci). ≥65 ans) = 1,6%) parmi un sous-ensemble de 44 759 patients sans antécédents psychiatriques connus. Ces valeurs étaient toutes significativement plus élevées que dans les cohortes témoins appariées de patients ayant reçu un diagnostic de grippe et d’autres infections des voies respiratoires.
À l’instar d’autres maladies graves, les complications du COVID-19 aigu, telles que les accidents vasculaires cérébraux ischémiques ou hémorragiques 146 , les lésions hypoxiques-anoxiques, le syndrome d’encéphalopathie postérieure réversible 147 et la myélite disséminée aiguë 148 , 149 , peuvent entraîner des déficits neurologiques persistants ou permanents nécessitant des réhabilitation. De plus, la myopathie aiguë de maladie critique et les neuropathies résultant du COVID-19 aigu ou de l’effet d’agents de blocage neuromusculaire peuvent laisser des symptômes résiduels persister pendant des semaines à 36 , 150 mois .
Pathologie et physiopathologie
Les mécanismes contribuant à la neuropathologie dans COVID-19 peuvent être regroupés en catégories chevauchantes d’infection virale directe, d’inflammation systémique sévère, de neuroinflammation, de thrombose microvasculaire et de neurodégénérescence 139 , 151 , 152 , 153 . Bien que des particules virales dans le cerveau aient déjà été signalées avec d’autres infections à coronavirus 154 , il n’y a pas encore de preuves convaincantes que le SRAS-CoV-2 infecte les neurones. Cependant, des séries d’autopsies ont montré que le SRAS-CoV-2 peut provoquer des modifications du parenchyme et des vaisseaux cérébraux, probablement par des effets sur les barrières hémato-encéphalique et hémato-encéphalique, qui provoquent l’inflammation des neurones, des cellules de soutien et du système vasculaire cérébral 155 , 156. De plus, les niveaux d’activation immunitaire sont directement corrélés aux changements cognitivo-comportementaux 157 . L’inflammation (une inflammation chronique du cerveau de bas niveau), ainsi que la capacité réduite à répondre aux nouveaux antigènes et une accumulation de cellules T à mémoire (caractéristiques de l’immunosénescence dans le vieillissement et les lésions tissulaires 158 ), peuvent jouer un rôle dans les effets persistants du COVID- 19. D’autres mécanismes proposés incluent le drainage lymphatique dysfonctionnel des organes circonventriculaires 159 , ainsi que l’invasion virale dans les espaces extracellulaires de l’épithélium olfactif et la diffusion passive et le transport axonal à travers le complexe olfactif 160. Biomarkers de lésions cérébrales, telles que les niveaux de sang périphérique élevés de la chaîne légère de neurofilaments, ont été trouvées chez des patients avec Covid-19 (réf. 161 ), avec une augmentation plus soutenue des infections graves 162 , ce qui suggère la possibilité d’ une lésion neuronale plus chronique.
Le brouillard cérébral post-COVID chez les patients gravement malades atteints de COVID-19 peut évoluer à partir de mécanismes tels que le déconditionnement ou le SSPT 141 . Cependant, les rapports de brouillard cérébral COVID-19 après un léger COVID-19 suggèrent que la dysautonomie peut également contribuer 163 , 164 . Enfin, la déficience cognitive à long terme est bien reconnue dans le contexte de la maladie post-critique, survenant chez 20 à 40% des patients sortis d’une unité de soins intensifs 165 .
Considérations de gestion
Des thérapies standard devraient être mises en place pour les complications neurologiques telles que les céphalées, avec une évaluation par imagerie et une référence à un spécialiste réservé aux céphalées réfractaires 166 . Une évaluation neuropsychologique plus poussée doit être envisagée dans le contexte de la maladie post-aiguë chez les patients atteints de troubles cognitifs. Des outils de dépistage standard devraient être utilisés pour identifier les patients souffrant d’anxiété, de dépression, de troubles du sommeil, de SSPT, de dysautonomie et de fatigue 76 , 141 .
Séquelles rénales
Épidémiologie et manifestations cliniques
Graves lésions rénales aiguë (AKI) nécessitant un traitement de suppléance rénale (RRT) se produit dans 5% de tous les patients hospitalisés et 20-31% des patients gravement malades avec Covid-19 aiguë, en particulier chez les personnes ayant des infections graves nécessitant une ventilation mécanique 167 , 168 , 169 , 170 . Les premières études avec suivi à court terme chez les patients nécessitant une RRT ont montré que 27 à 64% étaient indépendants de la dialyse à 28 jours ou à la sortie de l’USI 169 , 171 . Diminution du débit de filtration glomérulaire estimé (DFGe; défini comme <90 ml min -1 par 1,73 m 2) a été rapportée chez 35% des patients à 6 mois dans l’étude chinoise sur le COVID-19 post-aigu, et 13% ont développé une nouvelle réduction du DFGe après une fonction rénale normale documentée pendant le COVID-19 aigu (réf. 5 ). Avec des données de suivi adéquates à plus long terme, les patients qui nécessitent une RRT pour une AKI sévère présentent une mortalité élevée, avec une probabilité de survie de 0,46 à 60 jours et des taux de récupération rénale de 84% chez les survivants 170 .
Pathologie et physiopathologie
Le SRAS-CoV-2 a été isolé du tissu rénal 172 , et la nécrose tubulaire aiguë est la principale découverte notée à partir des biopsies rénales 173 , 174 et des autopsies 175 , 176 dans COVID-19. La néphropathie associée au COVID-19 (COVAN) est caractérisée par la variante d’effondrement de la glomérulosclérose segmentaire focale, avec involution de la touffe glomérulaire en plus d’une lésion tubulaire aiguë, et on pense qu’elle se développe en réponse à l’activation de l’interféron et de la chimiokine 177 , 178 . L’association avec les allèles de risque APOL1 suggère que le SRAS-CoV-2 agit comme un deuxième coup chez les patients sensibles, d’une manière similaire au virus de l’immunodéficience humaine et à d’autres virus.177 . Les thrombus dans la microcirculation rénale peuvent également contribuer potentiellement au développement de lésions rénales 179 .
Considérations de gestion
Bien que le fardeau de l’AKI dépendant de la dialyse au moment de la sortie soit faible, l’étendue de la récupération de la fonction rénale reste à voir. En conséquence, les survivants du COVID-19 présentant une insuffisance rénale persistante dans la phase infectieuse post-aiguë peuvent bénéficier d’un suivi précoce et rapproché avec un néphrologue dans les cliniques de survivants d’AKI, soutenu par son association antérieure avec de meilleurs résultats 180 , 181 .
Séquelles endocriniennes
Épidémiologie et manifestations cliniques
Une acidocétose diabétique (ACD) a été observée chez des patients sans diabète sucré connu des semaines à des mois après la résolution des symptômes du COVID-19 182 . On ne sait pas encore combien de temps la sévérité accrue du diabète préexistant ou de la prédisposition à l’acidocétose diabétique persiste après l’infection, ce qui sera traité par le registre international CoviDiab 183 . De même, une thyroïdite subaiguë avec thyrotoxicose clinique a été rapportée des semaines après la résolution des symptômes respiratoires 184 , 185 . Le COVID-19 peut également potentialiser l’auto-immunité thyroïdienne latente se manifestant par la thyroïdite de Hashimoto 186 ou la maladie de Graves 187 .
Pathologie et physiopathologie
Les manifestations endocriniennes dans le cadre du COVID-19 post-aigu peuvent être les conséquences d’une lésion virale directe, de lésions immunologiques et inflammatoires, ainsi que de complications iatrogènes. Un diabète préexistant peut apparaître pour la première fois pendant la phase aiguë du COVID-19 et peut généralement être traité à long terme avec des agents autres que l’insuline, même s’il est initialement associé à une ACD. Il n’y a aucune preuve concrète de dommages durables aux cellules β pancréatiques 188 . Bien que certaines études aient montré l’expression de l’ACE2 et de la sérine protéase transmembranaire (TMPRSS2; la protéase impliquée dans l’entrée cellulaire du SRAS-CoV-2) dans les cellules β 189 , le déficit primaire de la production d’insuline est probablement médié par des facteurs tels que l’inflammation ou la réponse au stress infectieux , ainsi que la résistance périphérique à l’insuline 188. Jusqu’à présent, il n’y a aucune preuve que le diabète associé au COVID-19 puisse être inversé après la phase aiguë, ni que ses résultats diffèrent chez les longs courriers COVID-19. Le COVID-19 présente également des facteurs de risque de déminéralisation osseuse liés à l’inflammation systémique, l’immobilisation, l’exposition aux corticostéroïdes, l’insuffisance en vitamine D et l’interruption des agents antirésorptifs ou anabolisants pour l’ostéoporose 190 .
Considérations de gestion
Des tests sérologiques pour les auto-anticorps associés au diabète de type 1 et des mesures répétées du peptide C postprandial doivent être effectués lors du suivi chez les patients atteints de diabète sucré nouvellement diagnostiqué en l’absence de facteurs de risque traditionnels de diabète de type 2, alors qu’il est raisonnable de traiter patients présentant de tels facteurs de risque apparentés au diabète de type 2 à tendance cétose 191 . L’hyperthyroïdie incidente due à une thyroïdite destructrice liée au SRAS-CoV-2 peut être traitée avec des corticostéroïdes, mais la maladie de Graves nouvellement apparue doit également être exclue 184 .
Séquelles gastro-intestinales et hépatobiliaires
Aucune séquelle gastro-intestinale et hépatobiliaire significative n’a été signalée chez les survivants du COVID-19 22 . Une excrétion fécale virale prolongée se produit dans le COVID-19, avec de l’acide ribonucléique viral détectable pendant une durée moyenne de 28 jours après l’apparition des symptômes de l’infection par le SRAS-CoV-2 et persistant en moyenne 11 jours après des échantillons respiratoires négatifs 192 , 193 , 194 , 195 .
Le COVID-19 a le potentiel d’altérer le microbiome intestinal, y compris l’enrichissement d’organismes infectieux opportunistes et l’épuisement des commensaux bénéfiques 196 , 197 . La capacité du microbiote intestinal à modifier l’évolution des infections respiratoires (axe intestin-poumon) a déjà été reconnue dans la grippe et d’autres infections respiratoires 198 . Dans COVID-19, Faecalibacterium prausnitzii , un anaérobie producteur de butyrate généralement associé à une bonne santé, a été inversement corrélé à la gravité de la maladie 196 , 199 . Des études évaluent actuellement les conséquences à long terme du COVID-19 sur le système gastro-intestinal, y compris le syndrome du côlon irritable post-infectieux et la dyspepsie (NCT04691895 ).
Séquelles dermatologiques
Manifestations dermatologiques de Covid-19 se sont produits après (64%) ou en même temps à (15%) d’ autres actifs Covid-19 symptômes dans une étude internationale de 716 patients avec Covid-19 (réf. 200 ), avec un temps de latence moyen à partir du moment de symptômes des voies respiratoires supérieures aux résultats dermatologiques de 7,9 jours chez l’adulte 201 . Seulement 3% des patients ont noté une éruption cutanée à 6 mois de suivi dans l’étude chinoise COVID-19 post-aiguë 5 . La plainte dermatologique prédominante était la perte de cheveux, qui a été notée chez environ 20% des patients 5 , 26 . La perte de cheveux peut être attribuée à un effluvium télogène résultant d’une infection virale ou d’une réponse au stress qui en résulte 5. Les investigations en cours peuvent fournir un aperçu des mécanismes immunitaires ou inflammatoires potentiels de la maladie 202 .
Syndrome inflammatoire multisystémique chez l’enfant (MIS-C)
Épidémiologie et manifestations cliniques
Le MIS-C, également appelé syndrome inflammatoire multisystémique pédiatrique associé temporellement au SRAS-CoV-2 (PIMS-TS), est défini par la présence des symptômes suivants chez les personnes de moins de 21 ans (ou ≤19 ans selon le Monde) Définition de l’Organisation sanitaire): fièvre; marqueurs inflammatoires élevés; dysfonctionnement de plusieurs organes; infection actuelle ou récente par le SRAS-CoV-2; et exclusion d’autres diagnostics plausibles 203 , 204 . Les présentations cliniques du MIS-C comprennent la fièvre, les douleurs abdominales, les vomissements, la diarrhée, les éruptions cutanées, les lésions cutanéo-muqueuses, l’hypotension et les compromis cardiovasculaires et neurologiques 205 , 206 . Des signes de chevauchement ont été observés avec la maladie de Kawasaki, une vascularite pédiatrique aiguë des vaisseaux moyens 207. Cependant, la comparaison de la maladie de Kawasaki et des cohortes MIS-C démontre des caractéristiques épidémiologiques et cliniques distinctes. Alors que 80% des cas de maladie de Kawasaki surviennent chez des enfants de moins de 5 ans et principalement d’origine asiatique 207 , les patients atteints de MIS-C sont généralement> 7 ans, couvrent une tranche d’âge plus large et sont d’origine africaine, afro-caribéenne ou hispanique 206 , 208 . Une incidence comparable d’anévrisme et de dilatation de l’artère coronaire a été notée parmi le MIS-C et la maladie de Kawasaki (20 et 25%, respectivement) 206 . Les complications neurologiques du MIS-C, telles que maux de tête, altération de l’état mental, encéphalopathie, paralysie du nerf crânien, accident vasculaire cérébral, convulsions, réduction des réflexes et faiblesse musculaire, semblent être plus fréquentes que dans la maladie de Kawasaki209 , 210 . Une méta-analyse groupée des études MIS-C a rapporté un rétablissement chez 91,1% et un décès chez 3,5% des patients 205 . Des études en cours évaluent les séquelles à long terme chez ces enfants ( NCT04330261 ).
Pathologie et physiopathologie
Le moment de l’apparition de MIS-C (qui était en retard d’ environ 1 mois de retard pic d’ incidence Covid-19 épicentres au printemps 2020 211 ) et la constatation que la plupart des patients sont négatifs pour l’ infection aiguë , mais sont d’ anticorps positifs suggèrent que MIS-C peut résultent d’une réponse immunitaire acquise aberrante plutôt que d’une infection virale aiguë 208 . Des informations sur la physiopathologie du MIS-C peuvent être tirées en partie de la maladie de Kawasaki et du syndrome de choc toxique, avec des mécanismes possibles de lésion liés aux complexes immuns, à l’activation du complément, à la formation d’autoanticorps par mimétisme viral de l’hôte et à la libération massive de cytokines liées à la stimulation superantigénique de Cellules T 205 , 211 .
Considérations de gestion
Les recommandations actuelles incluent un traitement immunomodulateur avec des immunoglobulines intraveineuses, des glucocorticoïdes d’appoint et de l’aspirine à faible dose jusqu’à ce que les artères coronaires soient confirmées normales au moins 4 semaines après le diagnostic 206 . Une anticoagulation thérapeutique à base d’énoxaparine ou de warfarine et d’aspirine à faible dose est recommandée chez les patients ayant un score z de l’ artère coronaire ≥ 10, une thrombose documentée ou une fraction d’éjection <35%. Des études telles que la meilleure étude de traitement disponible pour les affections inflammatoires associées au COVID-19 (ISRCTN69546370) évaluent le choix optimal d’agents immunomodulateurs pour le traitement.
Une évaluation échocardiographique en série est recommandée à des intervalles de 1 à 2 et 4 à 6 semaines après la présentation 212 . L’IRM cardiaque peut être indiquée 2 à 6 mois après le diagnostic chez les patients présentant un dysfonctionnement ventriculaire gauche transitoire significatif (fraction d’éjection <50%) en phase aiguë ou un dysfonctionnement persistant pour évaluer la fibrose et l’inflammation. Des électrocardiogrammes en série et la prise en compte d’un moniteur cardiaque ambulatoire sont recommandés lors des visites de suivi chez les patients présentant des anomalies de la conduction au moment du diagnostic.
Considérations particulières
Considérations raciales et ethniques
Il a été reconnu que le COVID-19 aigu affecte de manière disproportionnée les communautés de couleur 27 , 213 , 214 , 215 , 216 . Au total, 51,6% des survivants de l’étude américaine sur le COVID-19 post-aigu étaient des Noirs 20 , tandis que le groupe BAME représentait 19 à 20,9% dans les études britanniques 22 , 24 . Une seule étude du Royaume-Uni a évalué l’association race / origine ethnique et a rapporté que les individus appartenant au groupe BAME étaient plus susceptibles de souffrir de dyspnée que les Blancs (42,1 contre 25%, respectivement) 4 à 8 semaines après la sortie de l’hôpital 24. Les taux de SSPT étaient similaires chez les participants BAME et blancs de cette étude. Des données émergentes suggèrent également que COVAN pourrait être le modèle prédominant de lésion rénale chez les personnes d’ascendance africaine 177 . Il est également connu que le MIS-C affecte de manière disproportionnée les enfants et les adolescents d’origine africaine, afro-caribéenne ou hispanique 206 , 208 . Des études plus importantes sont nécessaires pour déterminer l’association entre les séquelles du COVID-19 post-aigu et la race et l’origine ethnique.
Ces différences importantes notées dans les études préliminaires peuvent être liées à de multiples facteurs, y compris (mais sans s’y limiter) les déterminants socio-économiques et les disparités raciales / ethniques, les différences plausibles dans l’expression des facteurs impliqués dans la pathogenèse du SRAS-CoV-2 et les comorbidités. Une expression épithéliale nasale plus élevée de TMPRSS2 a été rapportée chez les individus noirs par rapport à d’autres races / ethnies autodéclarées 217 . Cependant, il faut être prudent lorsque les études en cours et futures intègrent et analysent les informations selon plusieurs axes (par exemple, les axes cliniques et socio-économiques, les déficits de ressources et les facteurs de stress externes) pour éviter une contextualisation inexacte 218. L’Institut national sur la santé des minorités et les disparités en matière de santé des National Institutes of Health a identifié une enquête sur les effets à court et à long terme du COVID-19 sur la santé et sur la manière dont les résultats différentiels peuvent être réduits parmi les groupes raciaux et ethniques, en tant que priorité de recherche. 216 .
Considérations relatives à la nutrition et à la réadaptation
Le COVID-19 sévère, semblable à d’autres maladies graves, provoque une fonte musculaire catabolique, des difficultés d’alimentation et une fragilité, chacune étant associée à une probabilité accrue de mauvais résultats 36 . La malnutrition a été notée chez 26 à 45% des patients atteints de COVID-19, comme évalué par l’outil de dépistage universel de la malnutrition dans une étude italienne 219 . Les protocoles visant à fournir un soutien nutritionnel aux patients (dont beaucoup souffraient de détresse respiratoire, de nausées, de diarrhée et d’anorexie, avec une réduction de l’apport alimentaire qui en résulte) continuent d’être affinés 220 .
Toutes les études de suivi post-aigu du COVID-19 qui ont incorporé des évaluations de la qualité de vie liée à la santé et des mesures de la capacité fonctionnelle ont universellement signalé des déficits significatifs dans ces domaines, y compris à 6 mois dans l’étude chinoise post-aiguë COVID-19 3 , 5 , 20 . Compte tenu de la gravité de la réponse inflammatoire systémique associée à un COVID-19 sévère et à la fragilité qui en résulte, les programmes de rééducation précoce sont en cours d’évaluation dans des études cliniques en cours (tableau 2 ). Ils ont déjà été validés pour être à la fois la sécurité des patients et efficace dans un état critique avec SDRA 221 , 222 , 223 et dans les études préliminaires à Covid-19 (réf. 224). Les unités de rééducation du modèle COVID-19 comme celles d’Italie évaluent déjà régulièrement les survivants aigus du COVID-19 pour la fonction de déglutition, l’état nutritionnel et les mesures de l’indépendance fonctionnelle 219 .
Groupes de défense des patients
La création et le rôle de groupes de défense des patients pour identifier les symptômes persistants et influencer la recherche et l’attention clinique sont uniques à cette pandémie. Ces groupes comprennent COVID Advocacy Exchange ( https://www.covidadvocacyexchange.com ), le Centre de ressources de soins COVID de la National Patient Advocate Foundation ( https://www.patientadvocate.org/covidcare ), les groupes Facebook Groupe de soutien Body Politic COVID-19 ( https://www.wearebodypolitic.com/covid19 ), Survivor Corps ( https://www.survivorcorps.com/ ) et recherche menée par les patients pour COVID-19 ( patientresearchcovid19.com). Les enquêtes menées par ces groupes ont aidé à identifier les symptômes persistants tels que le brouillard cérébral, la fatigue et les courbatures comme des composants importants du COVID-19 post-aigu. En outre, ils ont contribué à mettre en évidence la persistance des symptômes chez les patients atteints d’une maladie légère à modérée qui n’ont pas nécessité d’hospitalisation 225 . Un engagement actif avec ces groupes de défense des patients, dont beaucoup s’identifient comme des transporteurs de longue durée, est crucial 226 . La diffusion des coordonnées et des ressources de ces groupes peut avoir lieu dans les pharmacies, les cabinets de médecins et dans les résumés de sortie à la sortie de l’hôpital.
Conclusions et orientations futures
Les séquelles multi-organes du COVID-19 au-delà de la phase aiguë de l’infection sont de plus en plus appréciées au fur et à mesure que les données et l’expérience clinique s’accumulent au cours de cette période. Les recherches actives et futures nécessaires comprennent l’identification et la caractérisation des principales caractéristiques cliniques, sérologiques, d’imagerie et épidémiologiques du COVID-19 dans les phases aiguës, subaiguës et chroniques de la maladie, ce qui nous aidera à mieux comprendre l’histoire naturelle et la physiopathologie de ce nouveau entité de la maladie (tableau 2). Des études cliniques actives et futures, y compris des cohortes prospectives et des essais cliniques, ainsi qu’un examen fréquent des preuves émergentes par des groupes de travail et des groupes de travail, sont essentiels pour développer une base de données de connaissances solide et informer la pratique clinique dans ce domaine. Actuellement, les professionnels de la santé qui s’occupent des survivants du COVID-19 aigu ont le rôle clé de reconnaître, de documenter soigneusement, d’enquêter et de gérer les symptômes en cours ou nouveaux, ainsi que de suivre les complications spécifiques à un organe qui se sont développées au cours d’une maladie aiguë. Il est également impératif que les cliniciens fournissent des informations dans des formats accessibles, y compris des études cliniques disponibles pour la participation et des ressources supplémentaires telles que la défense des patients et des groupes de soutien.
De plus, il est clair que les soins aux patients atteints de COVID-19 ne se terminent pas au moment de la sortie de l’hôpital, et une coopération interdisciplinaire est nécessaire pour une prise en charge complète de ces patients en ambulatoire. En tant que tel, il est essentiel que les systèmes de santé et les hôpitaux reconnaissent la nécessité de créer des cliniques COVID-19 dédiées 74, où des spécialistes de plusieurs disciplines sont en mesure de fournir des soins intégrés. La hiérarchisation des soins de suivi peut être envisagée pour les personnes à haut risque de COVID-19 post-aigu, y compris ceux qui ont eu une maladie grave pendant le COVID-19 aigu et / ou qui ont besoin de soins en unité de soins intensifs, les , les personnes âgées, celles qui présentent des comorbidités à plusieurs organes, celles qui ont suivi une transplantation et celles qui ont des antécédents de cancer actifs) et celles qui présentent le plus lourd fardeau de symptômes persistants.
Compte tenu de l’échelle mondiale de cette pandémie, il est évident que les besoins en soins de santé des patients présentant des séquelles du COVID-19 continueront d’augmenter dans un avenir prévisible. Pour relever ce défi, il faudra exploiter l’infrastructure ambulatoire existante, développer des modèles de soins de santé évolutifs et intégrer toutes les disciplines pour améliorer la santé mentale et physique des survivants du COVID-19 à long terme.
Les références
- 1.Dong, E., Du, H. & Gardner, L. Un tableau de bord interactif basé sur le Web pour suivre COVID-19 en temps réel. Lancet Infect. Dis. 20 , 533-534 (2020).CAS PubMed PubMed Central Google Scholar
- 2.Gupta, A. et coll. Manifestations extrapulmonaires du COVID-19. Nat. Med. 26 , 1017-1032 (2020).CAS PubMed Google Scholar
- 3.Carfi, A., Bernabei, R., Landi, F. & Gemelli Against COVID-19 Post-Acute Care Study Group. Symptômes persistants chez les patients après COVID-19 aigu. Confiture. Med. Assoc . 324 , 603–605 (2020).